3407 外源性DNA残留量测定法 在进行外源性DNA残留量测定时,可根据供试品具体情况选择下列任何一种方法进行测定。
第一法 DNA探针杂交法
供试品中的外源性DNA经变性为单链后吸附于固相膜上,在一定条件下可与相匹配的单链DNA复性而重新结合成为双链DNA,称为杂交。将特异性单链DNA探针标记后,与吸附在固相膜上的供试品单链DNA杂交,并使用与标记物相应的显示系统显示杂交结果,与已知含量的阳性DNA对照比对后,可测定供试品中外源性DNA残留量。
试剂 (1)DNA标记和检测试剂盒。
(2)DNA杂交膜 尼龙膜或硝酸纤维素膜。
(3)2%蛋白酶K溶液 称取蛋白酶K0.20g,溶于灭菌水(电阻率大于18.2MΩ?cm) 10ml中,分装后贮藏于-20℃备用。
(4)3%牛血清白蛋白溶液 称取牛血清白蛋白0.30g,溶于灭菌水(电阻率大于18.2MΩ?cm)10ml中。
(5)1mol/L三羟甲基氨基甲烷(Tris)溶液(pH8.0) 用适宜浓度盐酸溶液调pH值至8.0。
(6)5.0mol/L氯化钠溶液。
(7)0.5mol/L乙二胺四乙酸二钠溶液(pH8.0) 用10mol/L氢氧化钠溶液调pH值至8.0。
(8)20%十二烷基硫酸钠(SDS)溶液 用盐酸调pH值至7.2。
(9)蛋白酶缓冲液(pH8.0) 量取1mol/L Tris溶液 1.0ml(pH8.0)、5mol/L 氯化钠溶液2.0ml、0.5mol/L 乙二胺四乙酸二钠溶液(pH8.0)2.0ml、20%SDS溶液2.5ml,加灭菌水(电阻率大于18.2MΩ?cm)至10ml。如供试品遇氯化钠溶液发生沉淀反应,可免加氯化钠。
(10)TE 缓冲液(pH8.0) 量取1mol/L Tris 溶液(pH8.0)10ml、0.5mol/L 乙二胺四乙酸二钠溶液(pH8.0) 2ml,加灭菌水(电阻率大于18.2MΩ?cm)至1000ml。
(11)1%鱼精DNA溶液 精密称取鱼精DNA 0.10g,置10ml量瓶中,用TE缓冲液溶解并稀释至刻度,摇匀,用7号针头反复抽打以剪切DNA成为小分子,分装后贮藏于-20℃备用。
(12)DNA稀释液 取1%鱼精DNA溶液50μl,加TE缓冲液至10ml。
用于探针标记和阳性对照的DNA制备 用于探针标记和阳性对照的DNA,由生产供试品用的传代细胞、工程菌或杂交瘤细胞提取纯化获得,其提纯和鉴定可参考下述推荐方案进行,具体方法可参考《分子克隆实验指南》([美]J. 萨姆布鲁克等著,黄培堂等译,科学出版社,2002)或《精编分子生物学实验指南》([美]F.奥斯伯等著,颜子颖、王海林译,科学出版社,1998)。
将待提取的细胞基质悬液的细胞浓度调整为每1ml约含10
7个细胞,如果为细菌,则将其浓度调整为每1ml约含10
8个细菌。量取悬液1ml,离心,在沉淀中加裂解液400μl混匀,37℃作用12~24小时后,加入饱和苯酚溶液450μl, 剧烈振摇混匀,以每分钟10000转离心10分钟,转移上层液体,以饱和苯酚溶液450μl重复抽提1次;转移上层液体,加入三氯甲烷450μl,剧烈振摇混匀,以每分钟10000 转离心10分钟;转移上层液体,加入pH5.2的3mol/L醋酸钠溶液40μl,充分混合,再加入-20℃以下的无水乙醇1ml,充分混合,-20℃以下作用2小时,以每分钟15000 转离心15分钟;用适量-20℃70%乙醇溶液洗涤沉淀1次,以每分钟15000转离心15分钟,弃上清液,保留沉淀,吹至干燥后,加适量灭菌TE缓冲液溶解,RNase酶切,苯酚-三氯甲烷抽提,分子筛纯化DNA,即得。
用1%琼脂糖凝胶电泳法和分光光度法鉴定阳性对照品的DNA纯度:应无RNA和寡核苷酸存在;A
260/A
280比值应 在1.8~2.0之间(测定时将供试品稀释至A
260为0.2~1.0)。
用于阳性对照和标记探针的DNA在使用前应进行酶切或超声处理,使其片段大小适合于DNA杂交和探针标记。
阳性对照品的DNA浓度按下式计算:
DNA 浓度(μg/ml) = 50×A
260
阳性对照品可分装于适宜的小管中,-20℃以下保存,长期使用。
探针的标记 按试剂盒使用说明书进行。
测定法 (1)蛋白酶K预处理 按下表对供试品、阳性对照和阴性对照进行加样,混合后于37℃保温4小时以上, 以保证酶切反应完全。
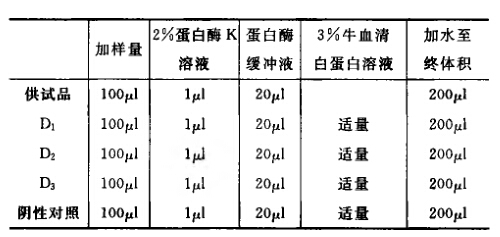
注意事项 供试品的稀释。
根据成品最大使用剂量,用DNA稀释液将供试品(原液)稀释至每100μl含1人份剂量;如成品最大使用剂量较大,而供试品的蛋白质含量较低,可用DNA稀释液将供试品稀释至每100μl含1/10人份剂量或每100μl含1/100人份剂量。
D
1、D
2、D
3为稀释的阳性DNA对照。用DNA稀释液稀释至每1ml中含DNA1000ng,然后依次10倍稀释成10ng/100μl (D
1)、1ng/100μl (D
2)、100pg/100μl (D
3)3个稀释度;如成品使用剂量较大,而且DNA限量要求 (100Pg/剂量)较严格时,则需要提高DNA检测灵敏度,相应的阳性DNA对照应稀释成100pg/100μl (D
1)、10pg/100μl (D
2)、1pg/100μl (D
3)3个稀释度。阴性对照为DNA稀释液,空白对照为未进行蛋白酶K预处理的TE缓冲液。
当供试品1/100人份剂量大于100μl时,终体积也随之增大,一般终体积为供试品体积的1倍左右,供试品体积和终体积相差过小,可能会影响蛋白酶K的活性。
2%蛋白酶K溶液和蛋白酶缓冲液的比例为1:20,蛋白酶缓冲液和终体积的比例为1:10。
加入3%牛血清白蛋白溶液适量,是为了使阳性对照和阴性对照中含有一定的蛋白质,与供试品(通常为蛋白质)的酶切条件保持一致;如供试品为其他物质,则应改用其他相应物质。
若预处理后的供试品溶液中的蛋白质干扰本试验,可用上述饱和苯酚溶液抽提法或其他适宜方法提取供试品DNA(阳性对照、阴性对照也应再次提取DNA,与供试品溶液平行)。
无论采用何种方式抽提,Vero细胞DNA参考品至少应能达到10pg的检测限。
供试品为疫苗制品时,供试品和阳性对照均采用TE缓冲液进行稀释。阴性对照为TE缓冲液。
(2)点膜 用TE缓冲液浸润杂交膜后,将预处理的供试品、阳性对照、阴性对照与空白对照置100℃水浴加热10分钟,迅速冰浴冷却,以每分钟8000转离心5秒。用抽滤加样器点样于杂交膜(因有蛋白质沉淀,故要视沉淀多少确定加样量,以避免加入蛋白质沉淀。所有供试品与阳性对照、阴性对照、空白对照加样体积应一致,或按同样比例加样)。晾干后可采用紫外交联法或置80℃真空干烤1小时以上。
(3)杂交及显色按试剂盒使用说明书进行。
结果判定 阳性对照应显色,其颜色深度与DNA含量相对应,呈一定的颜色梯度;阴性对照、空白对照应不显色,或显色深度小于阳性DNA对照D
3,试验成立。将供试品与阳性对照进行比较,根据显色的深浅判定供试品中外源性DNA的含量。
第二法荧光染色法
应用双链DNA荧光染料与双链DNA特异结合形成复合物,在波长480nm激发下产生超强荧光信号,可用荧光酶标仪在波长520nm处进行检测,在一定的DNA浓度范围内以及在该荧光染料过量的情况下,荧光强度与DNA浓度成正比,根据供试品的荧光强度,计算供试品中的DNA残留量。
试剂 (1) 1mol/L三羟甲基氨基甲烷(Tris)溶液(pH7.5)用盐酸调pH值至7.5。
(2)0.5mol/L乙二胺四乙酸二钠溶液(pH7.5) 用 10mol/L氢氧化钠溶液调pH值至7.5。
(3)TE 缓冲液(pH7.5) 量取 1mol/L Tris 溶液 (pH7.5)1.0ml、0.5mol/L 乙二胺四乙酸二钠溶液(pH7.5) 0.2ml,加灭菌注射用水至100ml。
(4)双链DNA荧光染料 按试剂使用说明书配制。
(5)DNA标准品 取DNA标准品适量溶于TE缓冲液中,制成50μg/mlDNA标准品,于-20℃保存。
DNA标准品浓度根据下式计算:
DNA 浓度(μg/ml) = 50×A
260
DNA标准品溶液的制备 用TE缓冲液将DNA标准品配成 0ng/ml、1.25ng/ml、2.5ng/ml、5.0ng/ml、10ng/ml、20ng/ml、40ng/ml、80ng/ml的标准品溶液。
测定法 精密量取DNA标准品溶液和供试品溶液各400μl于1.5ml离心管中,分别加入新配制的双链DNA荧光染料400μl,混匀后,避光室温放置5分钟。取250μl上述反应液于96孔黑色酶标板中,并做3个复孔。用荧光酶标仪在激发波长480nm、发射波长520nm处测定荧光强度。以TE缓冲液测得的荧光强度为本底,测定和记录各测定孔的荧光值。以标准品溶液的浓度对其相应的荧光强度作直线回归,求得直线回归方程(相关系数应不低于0.99),将供试品溶液的荧光强度代入直线回归方程,求出供试品中DNA残留量。
注意事项 (1)DNA残留量在1.25~80ng/ml范围内,本法线性较好,因此供试品DNA残留量在该范围内可定量 测定;当DNA残留量低于1.25ng/ml时应为限量测定,表示为小于1.25ng/ml。
(2)供试品首次应用本法测定时需要进行方法学验证,验证内容至少包括精密度试验和回收率试验。若供试品干扰回收率和精密度,应采用适宜方法稀释或纯化DNA(可参见本项目第一法)以排除干扰,直至精密度试验和回收率试验均符合要求。需要纯化DNA后再进行测定的供试品,每次测定均应从纯化步骤起增加回收率试验,并用回收率对测定结果进行校正。
关键字:3407 dna
 注意事项 供试品的稀释。
根据成品最大使用剂量,用DNA稀释液将供试品(原液)稀释至每100μl含1人份剂量;如成品最大使用剂量较大,而供试品的蛋白质含量较低,可用DNA稀释液将供试品稀释至每100μl含1/10人份剂量或每100μl含1/100人份剂量。
D1、D2、D3为稀释的阳性DNA对照。用DNA稀释液稀释至每1ml中含DNA1000ng,然后依次10倍稀释成10ng/100μl (D1)、1ng/100μl (D2)、100pg/100μl (D3)3个稀释度;如成品使用剂量较大,而且DNA限量要求 (100Pg/剂量)较严格时,则需要提高DNA检测灵敏度,相应的阳性DNA对照应稀释成100pg/100μl (D1)、10pg/100μl (D2)、1pg/100μl (D3)3个稀释度。阴性对照为DNA稀释液,空白对照为未进行蛋白酶K预处理的TE缓冲液。
当供试品1/100人份剂量大于100μl时,终体积也随之增大,一般终体积为供试品体积的1倍左右,供试品体积和终体积相差过小,可能会影响蛋白酶K的活性。
2%蛋白酶K溶液和蛋白酶缓冲液的比例为1:20,蛋白酶缓冲液和终体积的比例为1:10。
加入3%牛血清白蛋白溶液适量,是为了使阳性对照和阴性对照中含有一定的蛋白质,与供试品(通常为蛋白质)的酶切条件保持一致;如供试品为其他物质,则应改用其他相应物质。
若预处理后的供试品溶液中的蛋白质干扰本试验,可用上述饱和苯酚溶液抽提法或其他适宜方法提取供试品DNA(阳性对照、阴性对照也应再次提取DNA,与供试品溶液平行)。
无论采用何种方式抽提,Vero细胞DNA参考品至少应能达到10pg的检测限。
供试品为疫苗制品时,供试品和阳性对照均采用TE缓冲液进行稀释。阴性对照为TE缓冲液。
注意事项 供试品的稀释。
根据成品最大使用剂量,用DNA稀释液将供试品(原液)稀释至每100μl含1人份剂量;如成品最大使用剂量较大,而供试品的蛋白质含量较低,可用DNA稀释液将供试品稀释至每100μl含1/10人份剂量或每100μl含1/100人份剂量。
D1、D2、D3为稀释的阳性DNA对照。用DNA稀释液稀释至每1ml中含DNA1000ng,然后依次10倍稀释成10ng/100μl (D1)、1ng/100μl (D2)、100pg/100μl (D3)3个稀释度;如成品使用剂量较大,而且DNA限量要求 (100Pg/剂量)较严格时,则需要提高DNA检测灵敏度,相应的阳性DNA对照应稀释成100pg/100μl (D1)、10pg/100μl (D2)、1pg/100μl (D3)3个稀释度。阴性对照为DNA稀释液,空白对照为未进行蛋白酶K预处理的TE缓冲液。
当供试品1/100人份剂量大于100μl时,终体积也随之增大,一般终体积为供试品体积的1倍左右,供试品体积和终体积相差过小,可能会影响蛋白酶K的活性。
2%蛋白酶K溶液和蛋白酶缓冲液的比例为1:20,蛋白酶缓冲液和终体积的比例为1:10。
加入3%牛血清白蛋白溶液适量,是为了使阳性对照和阴性对照中含有一定的蛋白质,与供试品(通常为蛋白质)的酶切条件保持一致;如供试品为其他物质,则应改用其他相应物质。
若预处理后的供试品溶液中的蛋白质干扰本试验,可用上述饱和苯酚溶液抽提法或其他适宜方法提取供试品DNA(阳性对照、阴性对照也应再次提取DNA,与供试品溶液平行)。
无论采用何种方式抽提,Vero细胞DNA参考品至少应能达到10pg的检测限。
供试品为疫苗制品时,供试品和阳性对照均采用TE缓冲液进行稀释。阴性对照为TE缓冲液。