伤寒Vi多糖疫苗Shanghan Vi Duotang YimiaoVi Polysaccharide Typhoid Vaccine本品系用伤寒沙门菌培养液纯化的Vi多糖,经用PBS稀释制成。用于预防伤寒。
1 基本要求
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2 制造
2.1 菌种
生产用菌种应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
2.1.1 名称及来源
生产用菌种为伤寒沙门菌Ty2株,CMCC 50098。
2.1.2 种子批的建立
应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
2.1.3 种子批的传代
主种子批启开后传代次数不得超过5代。工作种子批启开后至接种发酵罐培养传代次数不得超过5代。
2.1.4 种子批的检定
2.1.4.1 培养特性
菌种接种于pH7.2~7.4的肉汤琼脂、马丁琼脂或其他适宜的培养基35~37℃培养16~20小时,应为无色半透明、边缘整齐、表面光滑湿润的圆形菌落。
2.1.4.2 染色镜检
应为革兰氏阴性杆菌。
2.1.4.3 生化反应
发酵葡萄糖、麦芽糖、甘露醇均产酸不产气;不发酵乳糖、蔗糖(通则3605);氧化酶试验阴性。
2.1.4.4 血清学试验
(1)玻片凝集试验
菌种的新鲜培养物与Vi及H-d参考血清有强凝集反应(+++以上),与Ο-9参考血清不产生凝集或仅有较弱凝集反应。
(2)定量凝集试验
菌种的新鲜培养物,用PBS制成6.0×10
8/ml的菌悬液,加入终浓度为0.5%的甲醛溶液,杀菌后的菌液(或直接用活菌菌液),与伤寒Vi参考血清做定量凝集试验;另取经100℃30分钟加热杀菌的菌液,与伤寒Ο参考血清做定量凝集试验。出现(+)凝集之血清最高稀释度为凝集反应效价,凝集效价应不低于参考血清原效价之半。
2.1.5 种子批的保存
种子批应冻干保存于8℃以下。
2.2 原液
2.2.1 生产用种子
启开工作种子批菌种,检定培养特性及染色镜检合格后,接种于改良半综合培养基或其他适宜培养基,制备数量适宜的生产用种子。
2.2.2 生产用培养基
采用改良半综合培养基或经批准的其他培养基。培养基不应含有与十六烷基三甲基溴化铵能形成沉淀的成分。
2.2.3 培养
采用培养罐液体培养。在培养过程中及杀菌前取样进行菌液浓度测定及纯菌检查,涂片做革兰氏染色镜检,如发现污染杂菌,应废弃。
2.2.4 收获及杀菌
培养物于对数生长期的后期或静止期的前期收获。取样进行菌液浓度测定及纯菌检查,合格后在收获的培养液中加入甲醛溶液杀菌,杀菌条件以确保杀菌完全又不损伤其多糖抗原为宜。
2.2.5 纯化
2.2,5.1 去核酸
将已杀菌的培养液离心后收集上清液,加入十六烷基三甲基溴化铵,充分混匀,形成沉淀;离心后的沉淀物用注射用水溶解,并加入适量氯化钠(或氯化钙)溶液,使多糖与十六烷基三甲基溴化铵解离;加入乙醇至最终浓度为25%,2~8℃静置1~3小时或过夜,离心收集澄清的上清液。
2.2.5.2 沉淀多糖
于上述上清液中加入乙醇至最终浓度为80%,充分振摇,离心收集沉淀;沉淀物用无水乙醇及丙酮分别洗涤,沉淀物即为多糖粗制品。多糖粗制品应保存在-20℃以下,待纯化。
2.2.5.3 多糖纯化
将多糖粗制品溶解于1/10饱和中性醋酸钠溶液中,稀释至适宜浓度,按适当比例用冷苯酚提取数次,离心收集上清液,并用0.1mol/L氯化钙溶液或其他适宜溶液透析或超滤;加入乙醇至最终浓度为75%~80%,离心收集的沉淀物用无水乙醇及丙酮分别洗涤,然后用灭菌注射用水溶解,除菌过滤后即为多糖原液。提取过程应尽可能在15℃以下进行。
2.2.6 原液检定
按3.1项进行。
2.2.7 保存及有效期
于-20℃以下保存。自收获杀菌之日起,疫苗总有效期应不超过60个月。
2.3 半成品
2.3.1 配制
用无菌、无热原PBS(pH6.5~7.5)稀释原液,可加入适量防腐剂。每1次人用剂量含多糖应不低于30μg。
2.3.2 半成品检定
按3.2项进行。
2.4 成品
2.4.1 分批
应符合“生物制品分批规程”规定。
2.4.2 分装
应符合“生物制品分装和冻干规程”规定。
2.4.3 规格
每瓶5ml(10次人用剂量)、1ml(2次人用剂量)、0.5ml(1次人用剂量)。每1次人用剂量0.5ml,含多糖应不低于30μg。
2.4.4 包装
应符合“生物制品包装规程”规定。
3 检定
3.1 原液检定
3.1.1 鉴别试验
采用免疫双扩散法(通则3403),本品与伤寒Vi血清48小时内应形成明显沉淀线,而与伤寒О血清不形成沉淀线。
3.1.2 化学检定
3.1.2.1 固体总量
依法测定(通则3101)。
3.1.2.2 蛋白质含量
应小于10mg/g(通则0731第二法)。
3.1.2.3 核酸含量
应小于20mg/g,核酸在波长260nm处的吸收系数(
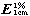
)为200(通则0401)。
3.1.2.4 О-乙酰基含量
应不低于2.0mmol/g(通则3117)。
3.1.2.5 多糖分子大小测定
多糖分子的K
D值在0.25以前的洗脱液多糖回收率应在50%以上(通则3420)。
3.1.2.6 苯酚残留量
应不高于0.1g/L(通则3111)。
3.1.3 无菌检查
依法检查(通则1101),应符合规定。
3.1.4 细菌内毒素检查
依法检查(通则1143),应符合批准的要求。
3.2 半成品检定
无菌检查
依法检查(通则1101),应符合规定。
3.3 成品检定
3.3.1 鉴别试验
按3.1.1项进行。
3.3.2 物理检查
3.3.2.1 外观
应为无色澄明液体,无异物。
3.3.2.2 装量
依法检查(通则0102),应不低于标示量。
3.3.2.3 渗透压摩尔浓度
依法检查(通则0632),应符合批准的要求。
3.3.3 化学检定
3.3.3.1 pH值
应为6.5~7.5(通则0631)。
3.3.3.2 防腐剂含量
如加苯酚作防腐剂,其含量应不高于3.0g/L(通则 3113)。
3.3.3.3 多糖含量
称取0.5~0.6g琼脂糖,加入0.05mol/L巴比妥缓冲液(pH8.6)40ml中,加热溶胀完全,待冷却至约56℃时,加入伤寒Vi血清1ml,混匀后迅速倾倒于12cm×6cm的洁净水平玻板上,待凝胶凝固后用直径3mm的打孔器在距底边1.5cm处打孔。各孔中分别加入各稀释好的伤寒Vi抗原标准品溶液(浓度分别为:100μg/ml、50μg/ml、25μg/ml、12.5μg/ml、6.25μg/ml)和本品5μl(本品做双孔)。靠近边缘一孔中,可加入10μl溴酚蓝指示液。加样后将玻板置于电泳槽上,滤纸搭桥,加样端与电泳仪阴极相连。采用0.05mol/L巴比妥缓冲液(pH8.6)为电极缓冲液,8V/cm恒压电泳至指示剂迁移到前沿。取下玻板浸泡于生理氯化钠溶液1~2小时后,覆盖洁净滤纸移至培养箱中过夜烤干。用考马斯亮蓝染色液染色至火箭峰出现,用甲醇-醋酸溶液脱色至背景清晰。准确测量火箭峰高,以标准品浓度的对数和相应的峰高作直线回归,得直线回归方程,将本品的峰高均值代入直线回归方程,求出本品浓度。每1次人用剂量多糖含量应不低于30μg。
3.3.3.4 О-乙酰基含量
每1次人用剂量应为0.061~0.091μmol(通则3117)。
3.3.4 无菌检查
依法检查(通则1101),应符合规定。
3.3.5 异常毒性检查
依法检查(通则1141),应符合规定。
3.3.6 热原检查
依法检查(通则1142),注射剂量按家兔体重每1kg注射0.025μg多糖,应符合规定。
3.3.7 细菌内毒素检查
依法检查(通则1143),应符合批准的要求。
4 保存、运输及有效期
于2~8℃避光保存和运输。自生产之日起,有效期为24个月。
5 使用说明
应符合“生物制品包装规程”规定和批准的内容。
伤寒Vi多糖疫苗使用说明
【药品名称】
通用名称:伤寒Vi多糖疫苗
英文名:称:Vi Polysaccharide Typhoid Vaccine
汉语拼音:Shanghan Vi Duotang Yimiao
【成分和性状】 本品系用伤寒沙门菌培养液纯化的Vi多糖,经用PBS稀释制成。为无色澄明液体。
有效成分:伤寒沙门菌Vi多糖。
辅料:应列出全部批准的辅料成分。
【接种对象】 主要用于部队、港口、铁路沿线的工作人员,下水道、粪便、垃圾处理人员,饮食行业、医务防疫人员及水上居民或有本病流行地区的人群。
【作用与用途】 接种本疫苗后,可使机体产生体液免疫应答。用于预防伤寒。
【规格】 每瓶5ml(10次人用剂量)、1ml(2次人用剖量)、0.5ml(1次人用剂量)。每1次人用剂量0.5ml,含伤寒Vi多糖应不低于30μg。
【免疫程序和剂量】 (1)上臂外侧三角肌肌内注射。
(2)注射1针,剂量为0.5ml。
【不良反应】
常见不良反应:
可出现短暂低热,局部稍有压痛感,一般可自行缓解,不需特殊处理。
极罕见不良反应:
过敏性皮疹:一般接种疫苗后72小时内出现,应及时就诊。
【禁忌】 (1)已知对该疫苗的任何成分过敏者。
(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者。
(3)妊娠期妇女。
【注意事项】 (1)以下情况者慎用:家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期妇女。
(2)用前摇匀。如出现摇不散的凝块、异物、疫苗瓶有裂纹或标签不清者,均不得使用.
(3)疫苗开启后应立即使用,如需放置,应置2~8℃,并于1小时内用完,剩余均应废弃。
(4)应备有肾上腺素等药物,以备偶有发生严重过敏反应时急救用。接受注射者在注射后应在现场观察至少30分钟。
(5)严禁冻结。
【贮藏】 于2~8℃避光保存和运输。
【包装】 按批准的执行。
【有效期】 24个月。
【执行标准】
【批准文号】
【生产企业】
企业名称:
生产地址:
邮政编码:
电话号码:
传真号码:
网 址:
关键字:伤寒 vi
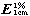 )为200(通则0401)。
3.1.2.4 О-乙酰基含量
应不低于2.0mmol/g(通则3117)。
3.1.2.5 多糖分子大小测定
多糖分子的KD值在0.25以前的洗脱液多糖回收率应在50%以上(通则3420)。
3.1.2.6 苯酚残留量
应不高于0.1g/L(通则3111)。
3.1.3 无菌检查
依法检查(通则1101),应符合规定。
3.1.4 细菌内毒素检查
依法检查(通则1143),应符合批准的要求。
3.2 半成品检定
无菌检查
依法检查(通则1101),应符合规定。
3.3 成品检定
3.3.1 鉴别试验
按3.1.1项进行。
3.3.2 物理检查
3.3.2.1 外观
应为无色澄明液体,无异物。
3.3.2.2 装量
依法检查(通则0102),应不低于标示量。
3.3.2.3 渗透压摩尔浓度
依法检查(通则0632),应符合批准的要求。
3.3.3 化学检定
3.3.3.1 pH值
应为6.5~7.5(通则0631)。
3.3.3.2 防腐剂含量
如加苯酚作防腐剂,其含量应不高于3.0g/L(通则 3113)。
3.3.3.3 多糖含量
称取0.5~0.6g琼脂糖,加入0.05mol/L巴比妥缓冲液(pH8.6)40ml中,加热溶胀完全,待冷却至约56℃时,加入伤寒Vi血清1ml,混匀后迅速倾倒于12cm×6cm的洁净水平玻板上,待凝胶凝固后用直径3mm的打孔器在距底边1.5cm处打孔。各孔中分别加入各稀释好的伤寒Vi抗原标准品溶液(浓度分别为:100μg/ml、50μg/ml、25μg/ml、12.5μg/ml、6.25μg/ml)和本品5μl(本品做双孔)。靠近边缘一孔中,可加入10μl溴酚蓝指示液。加样后将玻板置于电泳槽上,滤纸搭桥,加样端与电泳仪阴极相连。采用0.05mol/L巴比妥缓冲液(pH8.6)为电极缓冲液,8V/cm恒压电泳至指示剂迁移到前沿。取下玻板浸泡于生理氯化钠溶液1~2小时后,覆盖洁净滤纸移至培养箱中过夜烤干。用考马斯亮蓝染色液染色至火箭峰出现,用甲醇-醋酸溶液脱色至背景清晰。准确测量火箭峰高,以标准品浓度的对数和相应的峰高作直线回归,得直线回归方程,将本品的峰高均值代入直线回归方程,求出本品浓度。每1次人用剂量多糖含量应不低于30μg。
3.3.3.4 О-乙酰基含量
每1次人用剂量应为0.061~0.091μmol(通则3117)。
3.3.4 无菌检查
依法检查(通则1101),应符合规定。
3.3.5 异常毒性检查
依法检查(通则1141),应符合规定。
3.3.6 热原检查
依法检查(通则1142),注射剂量按家兔体重每1kg注射0.025μg多糖,应符合规定。
3.3.7 细菌内毒素检查
依法检查(通则1143),应符合批准的要求。
4 保存、运输及有效期
于2~8℃避光保存和运输。自生产之日起,有效期为24个月。
5 使用说明
应符合“生物制品包装规程”规定和批准的内容。
伤寒Vi多糖疫苗使用说明
)为200(通则0401)。
3.1.2.4 О-乙酰基含量
应不低于2.0mmol/g(通则3117)。
3.1.2.5 多糖分子大小测定
多糖分子的KD值在0.25以前的洗脱液多糖回收率应在50%以上(通则3420)。
3.1.2.6 苯酚残留量
应不高于0.1g/L(通则3111)。
3.1.3 无菌检查
依法检查(通则1101),应符合规定。
3.1.4 细菌内毒素检查
依法检查(通则1143),应符合批准的要求。
3.2 半成品检定
无菌检查
依法检查(通则1101),应符合规定。
3.3 成品检定
3.3.1 鉴别试验
按3.1.1项进行。
3.3.2 物理检查
3.3.2.1 外观
应为无色澄明液体,无异物。
3.3.2.2 装量
依法检查(通则0102),应不低于标示量。
3.3.2.3 渗透压摩尔浓度
依法检查(通则0632),应符合批准的要求。
3.3.3 化学检定
3.3.3.1 pH值
应为6.5~7.5(通则0631)。
3.3.3.2 防腐剂含量
如加苯酚作防腐剂,其含量应不高于3.0g/L(通则 3113)。
3.3.3.3 多糖含量
称取0.5~0.6g琼脂糖,加入0.05mol/L巴比妥缓冲液(pH8.6)40ml中,加热溶胀完全,待冷却至约56℃时,加入伤寒Vi血清1ml,混匀后迅速倾倒于12cm×6cm的洁净水平玻板上,待凝胶凝固后用直径3mm的打孔器在距底边1.5cm处打孔。各孔中分别加入各稀释好的伤寒Vi抗原标准品溶液(浓度分别为:100μg/ml、50μg/ml、25μg/ml、12.5μg/ml、6.25μg/ml)和本品5μl(本品做双孔)。靠近边缘一孔中,可加入10μl溴酚蓝指示液。加样后将玻板置于电泳槽上,滤纸搭桥,加样端与电泳仪阴极相连。采用0.05mol/L巴比妥缓冲液(pH8.6)为电极缓冲液,8V/cm恒压电泳至指示剂迁移到前沿。取下玻板浸泡于生理氯化钠溶液1~2小时后,覆盖洁净滤纸移至培养箱中过夜烤干。用考马斯亮蓝染色液染色至火箭峰出现,用甲醇-醋酸溶液脱色至背景清晰。准确测量火箭峰高,以标准品浓度的对数和相应的峰高作直线回归,得直线回归方程,将本品的峰高均值代入直线回归方程,求出本品浓度。每1次人用剂量多糖含量应不低于30μg。
3.3.3.4 О-乙酰基含量
每1次人用剂量应为0.061~0.091μmol(通则3117)。
3.3.4 无菌检查
依法检查(通则1101),应符合规定。
3.3.5 异常毒性检查
依法检查(通则1141),应符合规定。
3.3.6 热原检查
依法检查(通则1142),注射剂量按家兔体重每1kg注射0.025μg多糖,应符合规定。
3.3.7 细菌内毒素检查
依法检查(通则1143),应符合批准的要求。
4 保存、运输及有效期
于2~8℃避光保存和运输。自生产之日起,有效期为24个月。
5 使用说明
应符合“生物制品包装规程”规定和批准的内容。
伤寒Vi多糖疫苗使用说明