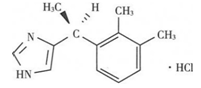
C13H16N2·HC1 236.73
本品为(S) -4- [1- (2, 3-二甲基苯基)乙基]-1H-咪唑盐酸盐。按干燥品计算,含C13H16N2·HC1应为 98.0%-102.0%。
【性状】本品为白色或类白色结晶粉末。
本品在水、濱甲烷、乙醇和甲醇中易溶,在乙腈中微溶。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱(附录28页)应与对照品的图谱一致。(3)本品的水溶液显氯化物的鉴别反应(附录25页)。【检查】酸碱度 取本品约24g,置100ml量瓶中,用少量水溶解;加饱和氯化钾溶液0.3ml,用 水稀释至刻度,依法测定(附录56页),pH值应为4.7-5.7。
有关物质 取本品约20mg,精密称定,置10ml量瓶中,用流动相溶解并稀释至刻度,作为供试品溶液;取盐酸右美托咪定对照品适量,精密称定,用流动相溶解并稀释制成每1ml中约含10ug的溶液,作为对照品溶液a;再用流动相稀释制成每1ml中约含0.8ug的溶液,作为对照品溶液b。照高效液相色谱法(附录36页)测定。用十八烷基硅烷键合硅胶为填充剂(LiChrospher 10O RP-18色谱柱,125mm×4mm,5um或等效色谱柱);以甲醇-0.005M磷酸缓冲液(取Na2HPO4·2H2O 1.78g,置 2000ml量瓶中,用1500ml水溶解;用Na2HPO4·2H2O约1gpH值至7.0,用水稀释至刻度)(60:40)为流动相;检测波长为220nm。用对照品溶液a进行色谱系统适用性检验,6次重复进样的盐酸右美托咪定峰面积的相对标准差不得过3.0%。精密量取供试品溶液和对照品溶液b各20ul,注入液相色谱仪,记录色谱图至70分钟。供试品溶液色谱图中如有杂质峰,按外标法以峰面积计算,任何单一非特定杂质不得过0.1%,非特定杂质的总量不得过0.3%。盐酸左美托咪定 取本品约l0mg,精密称定,用流动相溶解并稀释制成每1ml中约含50ug的溶液,作为供试品溶液;取盐酸左美托咪定对照品约l0mg,精密称定,用流动相溶解并稀释制成每1ml中约含0.5ug的溶液,作为对照品溶液a,另取适量用流动相稀释制成每1ml中约含0.25ug的溶液,作为对照品溶液b。照高效液相色谱法(附录36页)测定。用CHIRAL-AGP (al-酸性糖蛋白,100mm×4mm,5um)色谱柱;以乙腈-0.03M磷酸盐缓冲液(取KH2PO4 4.08g溶于1000ml水;取Na2HP04 ? 2H2O 5.34g 溶于1000ml水。用KH2P04溶液约700-800ml 调节Na2HP04·2H20溶液的pH值至7.0) (175:825)流动相;检测波长为220nm。分别取盐酸左美托咪啶和盐酸右美托咪定适量,用流动相制成每1ml中含0.1mg和0.5mg的溶液,分别取1ml和10ml置同一100ml量瓶中,加流动相至刻度,作为系统适用性溶液。精密量取系统适用性溶液和对照品溶液α各20ul,注入液相色谱仪,记录色谱图。系统适用性溶液色谱图中左美托咪啶峰相对于右美托咪定峰的保留时间不得过0.80。对照品溶液a 6次进样盐酸左美托咪定峰峰高的相对标准差不得过5.0%。精密量取供试品溶液和对照品溶液b各20ul,注入液相色谱仪,记录色谱图。按外标法以峰高计算,即得。含盐酸左美托咪定的量应不得过1.0%。乙酸乙酯与异丙醇 以0.01% 2-丁醇溶液作为内标溶液。取本品0.5g,精密称定,置5ml量瓶中,加内标溶液2.5ml,用N,N-二甲基甲酰胺溶解并稀释至刻度,作为供试品溶液。精密称取乙酸乙酯和异丙醇各1g,分别置l00ml量瓶中,用N,N-二甲基甲酰胺稀释至刻度,作为贮备溶液。分别取乙酸乙酯贮备溶液0.3ml和异丙醇贮备溶液0.1ml,置同一10ml量瓶中,加内标溶液5.0ml,用N,N-二甲基甲酰胺至刻度,作为对照品溶液。照残留溶剂测定法(附录81页,第二法),以FFAP Megabore (30m×0.53mm×1um) 毛细管柱为色谱柱;初始柱温为 50°C, 保持8 分钟后,以每分钟升温 15°C的速率升温至175°C,并保持3分钟;检测器为氢火焰离子化检测器(FID),检测器温度为 250°C;进样口温度为180°C;进样瓶平衡温度为80°C。取对照品溶液顶空进样,各主峰之间的分离度均应符合要求。分别取供试品溶液和对照品溶液顶空进样,记录色谱图,按外标法以峰面积计算,乙酸乙酯不得过0.3%,异丙醇不得过0.1%。乙酸乙酯、异丙醇和2-丁醇的保留时间分别约为2.7分钟、3.0分钟和4.1分钟。干燥失重 取本品,在l05°C干燥3小时,减失重量不得过1.0% (附录78页)。炽灼残渣 不得过0.1% (附录80页)。细菌内毒素 取本品适量,用不含内毒素的水溶解并稀释制成每1ml含1mg的溶液,依法检查 (附录130页),每1mg盐酸右美托咪定中含内毒素的量不得过20EU。微生物限度 照微生物限度检查法(附录143页)检查,每1g供试品中需氧菌活菌总数不得过 10Ocfu。【含量测定】照高效液相色谱法(附录36页)测定。
色谱条件与系统适用性试验用LiChrospher 100 RP- 18色谱柱(125mm×4mm,5um或等效色谱柱以甲醇-0.005M磷酸缓冲液(取Na2HP04·2H20 1.78g,置2000ml量瓶中,用1500ml水 溶解,用NaH2P04 ·2H20约1g调pH值至7.0,加水至刻度)(60:40)为流动相;检测波长为220nm。6次进样的盐酸右美托咪定对照品峰面积的相对标准差应不得过2.0%。测定法 取本品约50mg,精密称定,用流动相溶解并稀释制成每1ml中约含0.2mg的溶液,精密 量取20ul,注入液相色谱仪,记录色谱图。另取盐酸右美托咪定对照品适量,同法测定。按外标法以峰面积计算,即得。【作用与用途】拟肾上腺素类药。用作犬、猫的镇静剂和止痛剂,便于临床检查、临床治疗、小的手术和小的牙处理。也可用于犬深度麻醉前的前驱麻醉剂。
【贮藏】在15-30°C下遮光保存。
【有效期】5年。
【制剂】盐酸右美托咪定注射液。
【生产企业】芬兰Fermion Oy制药厂Oulu生产厂(Fermion Oy Oulu Plant)。
附:盐酸左美托咪定(Levomedeto midine hydroch10ride): 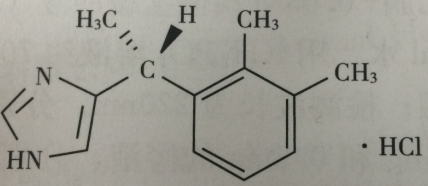
(2011)外兽药证字44号。